Цытазоль

Цытазо́ль (англ.: cytosol, паходзіць ад грэч. κύτος — клетка і англ.: sol ад лац.: solutio — раствор) — вадкае змесціва клеткі. Большую частку цытазолю займае ўнутрыклеткавая вадкасць. Цытазоль разбіваецца на кампартменты пры дапамозе разнастайных мембран. У эўкарыётаў цытазоль размяшчаецца пад плазматычнай мембранай і з’яўляецца часткай цытаплазмы, у якую, апроч цытазоля, уваходзяць мітахондрыі, пластыды і іншыя арганелы, але не вадкасць, якая змяшчаецца ў іх, і ўнутраныя структуры. Такім чынам, цытазоль уяўляе сабой вадкі матрыкс, які атачае арганелы. У пракарыётаў большая частка хімічных рэакцый метабалізму адбываецца ў цытазолі, і толькі невялікая іх частка адбываецца ў мембранах і перыплазматычнай прасторы. У эўкарыётаў, хоць многія рэакцыі працякаюць у арганелах, некаторыя рэакцыі адбываюцца ў цытазолі.
Хімічна цытазоль уяўляе сабой складаную сумесь рэчываў, раствораных у вадкасці. Хоць большая частка цытазоля прадстаўлена вадой, яго структура і ўласцівасці ўнутры клетак вывучаны недастаткова. Канцэнтрацыі іонаў, такіх як катыёны калію і натрыю, адрозніваюцца ў цытазолі і пазаклетачнай вадкасці. Гэта розніца канцэнтрацый істотная для такіх працэсаў, як осмарэгуляцыя, перадача сігналу і генерацыя патэнцыялу дзеяння ва ўзбудлівых клетках, такіх як эндакрынныя, нервовыя і мышачныя клеткі. У цытазолі таксама ўтрымліваецца шмат макрамалекул, якія могуць змяняць паводзіны малекул пасродкам эфекту цеснаты макрамалекул (англ.: Macromolecular crowding).
Хоць раней цытазоль разглядалі як просты раствор малекул, ён мае некалькі ўзроўняў арганізацыі. Сярод градыенты канцэнтрацый іонаў (напрыклад, кальцыю), буйныя ферментатыўныя комплексы, якія ўзаемадзейнічаюць адзін з адным і ажыццяўляюць разнастайныя хімічныя рэакцыі, а таксама бялковыя комплексы накшталт карбаксісом і пратэасом, якія змяшчаюць у сабе частку цытазоля.
Вызначэнне[правіць | правіць зыходнік]
Тэрмін «цытазоль» быў прапанаваны ў 1965 годзе Генры Лардзі (англ.: Henry A. Lardy) і першапачаткова выкарыстоўваўся ў дачыненні да вадкасці, якая выходзіць з пашкоджаных клетак і пры ўльтрацэнтрыфугаванні[2][3] якой асядаюць нерастваральныя кампаненты. Растваральныя клетачныя экстракты не ідэнтычныя растваральнай частцы цытаплазмы і звычайна называюцца цытаплазматычнай фракцыяй[4].
У наш час тэрмін «цытазоль» выкарыстоўваецца для абазначэння вадкай фракцыі цытаплазмы інтактнай клеткі[4]. У склад цытазоля не ўваходзяць вадкасці, размешчаныя ўнутры арганел[5]. Каб пазбегнуць блытаніны ва ўжыванні тэрміна «цытазоль» у дачыненні да вадкай часткі цытаплазмы і экстрактаў клетак, для абазначэння вадкай часткі цытаплазмы жывых клетак часам выкарыстоўваецца тэрмін «вадзяністая цытаплазма» (англ.: aqueous cytoplasm)[3].
Уласцівасці і склад[правіць | правіць зыходнік]
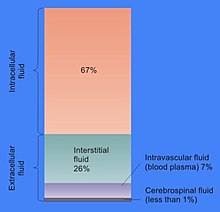
Доля аб’ёму клеткі, якая прыпадае на цытазоль, вар’іруецца: у той час як у бактэрый цытазоль забяспечвае захаванне структуры клеткі і займае амаль увесь яе аб’ём, у раслін большая частка аб’ёму клеткі прыпадае на буйную цэнтральную вакуолю[6]. Цытазоль складаецца, галоўным чынам, з вады, раствораных іонаў, малых малекул і буйных водарастваральных малекул (напрыклад, бялкоў). Большая частка небялковых малекул цытазоля мае масу да 300 Да[7]. Цытазоль уключае каласальную колькасць метабалітаў: напрыклад, у раслін у клетках павінна ўтварацца да 200 000 метабалітаў[8], а ў адной дражджавы клетцы ці клетцы бактэрыі Escherichia coli павінна ўтварацца каля тысячы малекул[9][10].
Вада[правіць | правіць зыходнік]
Большую частку аб’ёму цытазоля складае вада (каля 70 % у тыповай клетцы)[11]. рН унутрыклеткавай вадкасці складае 7,4[12], пры гэтым у чалавека рН цытазоля складае ад 7,0 да 7,4 і мае большае значэнне ў выпадку клетак, якія растуць[13]. Вязкасць цытаплазмы прыкладна такая ж, як у вады, хоць хуткасць дыфузіі малых малекул праз гэту вадкасць прыкладна ў 4 разы меншая, за дыфузію ў чыстай вадзе, з-за сутыкненняў са шматлікімі макрамалекуламі[14]. На прыкладзе рачкоў-арцемій было паказана, як вада ўплывае на клетачныя функцыі. Паказана, што скарачэнне долі вады ў клетцы на 20 % спыняе метабалізм, прычым пры высыханні клеткі хуткасць метабалізму змяшаецца з прагрэсіяй, і ўсякая метабалічная актыўнасць спыняецца, калі ўзровень вады ў клетцы змяншчаецца на 70 % ніжэй за норму[3].
Хоць вада неабходная для жыцця, структура гэтай вады ў цытазолі вывучана слаба, таму што метады накшталт ядзернага магнітнага рэзанансу і спектраскапіі даюць толькі толькі агульную інфармацыю пра структуру вады, не ўлічваючы мікраскапічныя варыяцыі. Нават структура чыстай вады зразумела дрэнна з-за схільнасці вады ўтвараць вадзяныя кластары пасродкам вадародных сувязяў[15].
Класічнае ўяўленне пра ваду ў клетцы такое, што каля 5 % вады знаходзіцца ў звязаным з іншымі рэчывамі стане (гэта значыць забяспечвае сальватацыю), а астатняя вада мае такую ж структуру, як чыстая вада[3]. Сальватавальная вада неактыўная пры осмасе і можа мець іншыя ўласцівасці як растваральнік, канцэнтруючы адны малекулы і выштурхваючы іншыя[16]. Паводле іншага пункта гледжання, на ўвесь цытазоль велізарны ўплыў аказвае вялікая колькасць раствораных макрамалекул, і паводзіны цытазольнай вады моцна адрозніваюцца ад паводзін чыстай вады[17]. Існуе здагадка, што ўнутры клеткі маюцца ўчасткі большай ці меншай шчыльнасці вады, якія могуць аказваць моцны ўплыў на структуру і функцыі іншых частак клеткі[15][18]. Аднак вынікі ядзернага магнітнага рэзанансу супярэчаць гэтай здагадцы, таму што, паводле гэтых вынікаў, 85 % вады клеткі паводзіць сябе як чыстая вада, а астатняя вада знаходзіцца ў звязаным з макрамалекуламі стане і меней рухомая[19].
Іоны[правіць | правіць зыходнік]
Канцэнтрацыі іонаў у цытазолі карэнным чынам адрозніваюцца ад такіх у пазаклетачнай вадкасці, акрамя таго, у цытазолі змяшчаецца больш зараджаных малекул, такіх як бялкі і нуклеінавыя кіслоты. У табліцы ніжэй разглядаюцца канцэнтрацыі ключавых іонаў у вадзе і ў пазаклетачнай вадкасці.
| Іон | Канцэнтрацыя ў цытазоль (мМ) | Concentration in blood (мМ) |
|---|---|---|
| Калій | 139 | 4 |
| Натрый | 12 | 145 |
| Хлор | 4 | 116 |
| Бікарбанат | 12 | 29 |
| Амінакіслоты ў бялках | 138 | 9 |
| Магній | 0,8 | 1,5 |
| Кальцый | < 0,0002 | 1,8 |
У адрозненне ад пазаклетачнай вадкасці, цытазоль мае вялікую канцэнтрацыю іонаў калію і меншую канцэнтрацыю іонаў натрыю[20]. Гэта адрозненне ў канцэнтрацыі іонаў неабходна для осмарэгуляцыі. Калі б канцэнтрацыі іонаў унутры клеткі і па-за яе былі аднолькавыя, паводле законаў осмасу вада б бесперапынна паступала ў клетку з-за таго, што клетка ўтрымлівае больш макрамалекул, чым іх маецца звонку. Іоны натрыю выпампоўваюцца з клеткі, а іоны калію, насупраць, запампоўваюцца ферментам Na+/K±АТФ-азай. Далей іоны калію рухаюцца па градыенце канцэнтрацыі вонкі праз каліевыя каналы, і выхад катыёнаў выклікае адмоўны мембранны патэнцыял. Каб збалансаваць розніцу ў патэнцыялах, з клеткі таксама выходзяць адмоўна зараджаныя іоны хлору праз спецыяльныя хларыдныя каналы. Страта іонаў натрыю і хлору кампенсуе асматычны эфект высокай канцэнтрацыі макрамалекул унутры клеткі[20].
Клеткі могуць вытрымліваць яшчэ большую розніцу ў патэнцыялах, накопліваючы ў цытазолі осмапратэктары, такія як трэгалоза і бэтаіны[20]. Некаторыя з гэтых малекул дапамагаюць клетцы выжыць пры поўным высушванні і ўваходжанні ў крыптабіёз[21]. У гэтым стане цытазоль і осмапратэктары ператвараюцца ў шклопадобнае цвёрдае рэчыва, якое засцерагае клетачныя бялкі і мембраны ад пашкоджанняў пры высыханні[22].
Дзякуючы нізкай канцэнтрацыі кальцыю ў цытаплазме ён можа працаваць як другасны пасроднік у кальцыевых шляхах перадачы сігналу. У гэтым выпадку сігнал, такі як малекула гармону ці патэнцыял дзеяння, адкрывае кальцыевыя каналы, па якіх кальцый накіроўваецца ў цытазоль[23]. Павелічэнне канцэнтрацыі кальцыю ў цытазолі актывуе іншыя сігнальныя малекулы, такія як кальмадулін і пратэінкіназа C[24]. Іншыя іоны, такія як іоны хлору і калію, таксама могуць выконваць сігнальныя ролі ў цытазолі, але гэта роля ў наш час дрэнна вывучана[25].
Макрамалекулы[правіць | правіць зыходнік]
Бялковыя малекулы, якія не прымацаваны да мембран ці цыташкілету, раствораны ў цытазолі. Колькасць бялкоў у клетках надзвычай вяліка і набліжаецца да 200 мг/мл, бялкі займаюць ад 20 да 30 % усёй клеткі[1]. Аднак вымярэнне дакладнай колькасці бялку ў цытазолі інтактнай клеткі вельмі складанае, паколькі некаторыя бялкі слаба звязаны з мембранамі ці арганеламі і выходзяць у раствор пры лізісе клетак[3]. Сапраўды, эксперыменты, у якіх плазматычная мембрана клеткі акуратна разбуралася пад дзеяннем сапаніну без пашкоджання іншых мембран, паказалі, што вонкі выходзіць чвэрць бялкоў. Такія паўразбураныя клеткі былі здольныя, тым не менш, сінтэзаваць бялкі, калі ў доступе ёсць АТФ і амінакіслоты, таму многія бялкі цытазоля ў рэчаіснасці звязаны з цыташкілетам[26]. Аднак ідэя аб тым, што большасць бялкоў трывала звязаны з сеткай, званай мікратрабекулярная рашотка (англ.: microtrabecular lattice), у наш час уяўляецца малаверагоднай[27].
У пракарыётаў геном змяшчаецца ў цытазолі ў выглядзе структуры, названай нуклеоідам[28]. Нуклеоід уяўляе сабой неўпарадкаваную масу ДНК і асацыяваных бялкоў, якія кантралююць рэплікацыю і транскрыпцыю бактэрыяльнай храмасомы і плазмід. У эўкарыётаў геном змешчаны ў ядры, якое аддзеленае ад цытазоля ядзернымі порамі, якія не дапускаюць свабоднага праходжання малекул дыяметрам звыш 10 нм[29].
Высокая канцэнтрацыя малекул у цытазолі спараджае эфект, вядомы як макрамалекулярнае ўшчыльненне, пры якім эфектыўная канцэнтрацыя малекул павялічваецца, паколькі ў іх няма месца для свабоднага руху. Гэты эфект можа выклікаць істотныя змены ў хуткасці хімічнай рэакцыі і становішчы раўнавагі[1]. Яго дзеянне на змену канстант дысацыяцыі асабліва важнае, паколькі дзякуючы гэтаму спрыяльнай становіцца асацыяцыя макрамалекул, напрыклад, зборка бялкоў у мультыбялковы комплекс і злучэнне ДНК-злучальных бялкоў са сваёй мішэнню на малекуле ДНК[30].
Арганізацыя[правіць | правіць зыходнік]
Хоць кампаненты цытазоля не аддзелены адзін ад аднаго мембранамі, яны не змешваюцца адзін з адным выпадковым чынам, і ўнутры цытазоля маецца некалькі ўзроўняў арганізацыі, якія лакалізоўваюць малекулы ў спецыяльных сайтах цытазоля[31].
Градыенты канцэнтрацыі[правіць | правіць зыходнік]
Хоць дробныя малекулы хутка дыфундзіруюць у цытазолі, унутры цытазоля могуць падтрымлівацца спецыяльныя градыенты канцэнтрацыі. Добрым прыкладам могуць служыць «кальцыевыя ўспышкі» (англ.: calcium sparks), якія з’яўляюцца на кароткі тэрмін ва ўчастку побач з адкрытым кальцыевым каналам[32]. «Успышкі» дасягаюць каля 2 мкм у дыяметры і доўжацца ўсяго некалькі мілісекунд, хоць некаторыя ўспышкі могуць злівацца з ўтварэннем буйнейшых градыентаў — «кальцыевых хваль» (англ.: calcium waves)[33]. Градыенты канцэнтрацыі іншых малых малекул, такіх як кісларод і АТФ, могуць утварацца каля кластараў мітахондрый, але механізм іх утварэння менш зразумелы[34][35].
Бялковыя комплексы[правіць | правіць зыходнік]
Бялкі могуць асацыявацца адзін з адным з утварэннем бялковых комплексаў, якія часта змяшчаюць набор бялкоў з падобнымі функцыямі, напрыклад, набор ферментаў, якія каталізуюць розныя этапы аднаго і таго ж метабалічнага шляху[36]. Дзякуючы гэтаму фарміруюцца субстратныя каналы (англ.: Substrate channeling), пры якіх прадукты рэакцыі аднаго фермента перадаюцца непасрэдна наступнаму ферменту шляху без вызвалення ў раствор[37]. Субстратныя каналы могуць зрабіць метабалічны шлях больш хуткім і эфектыўным, чым калі б ферменты размяшчаліся ў цытазолі выпадковым чынам, і прадухіляюць выхад у раствор нестабільных прамежкавых прадуктаў шляху[38]. Хоць у вялікай колькасці метабалічных шляхоў ферменты шчыльна звязаны адзін з адным, існуюць і больш слаба звязаныя ферментныя комплексы, якія вельмі цяжка вывучаць па-за клеткай. Таму і значнасць гэтых комплексаў для метабалізму застаецца незразумелай[39][40].
Бялковыя кампартменты[правіць | правіць зыходнік]

Некаторыя бялковыя комплексы змяшчаюць унутры поласць, ізаляваную ад цытазоля. Прыкладам такога комплексу можа служыць пратэасома[41]. Набор субадзінак пратэасомы фарміруе полая «бочачка», якая змяшчае пратэазы, якія разбураюць цытаплазматычныя бялкі. Прысутнасць у цытаплазме няправільна выкладзеных бялкоў небяспечная, таму «бочачка» пакрыты рэгулятарнымі бялкамі, якія распазнаюць бялкі з меткай аб дэградацыі (убіквітынавай меткай) і накіроўваюць іх у пратэасому для разбурэння[42].
Іншы клас бялковых кампартментаў — бактэрыяльныя мікракампартменты, якія складаюцца з бялковай абалонкі, якая змяшчае ў сабе разнастайныя ферменты[43]. Звычайна такія кампартменты маюць памер 100—200 нм і складаюцца са шчыльна падагнаных адзін да аднаго бялкоў[44]. Добра вывучаным ферментам можа служыць карбаксісома, якая змяшчае ферменты фіксацыі вугляроду (напрыклад, рубіска)[45].
Цыташкілетнае сіта[правіць | правіць зыходнік]
Хоць цыташкілет не з’яўляецца часткай цытазоля, прысутнасць гэтай сеткі філаментаў абмяжоўвае дыфузію буйных часціц унутры клеткі. Напрыклад, у некалькіх эксперыментах кантрольныя часціцы памерам каля 25 нм (амаль як рыбасома[46]) выдаляліся з частак цытазоля, размешчаных каля мяжы клеткі і клетачнага ядра[47][48]. Такія кампартменты могуць змяшчаць гусцейшую за астатнюю цытазоль сетку з акцінавых філаментаў. Гэтыя мікрадамены могуць уплываць на размяшчэнне буйных часціц накшталт рыбасомы і іншых арганел, канцэнтруючы іх у адных месцах клеткі і выцясняючы з іншых[49].
Функцыі[правіць | правіць зыходнік]
У цытазоля няма нейкай адной функцыі, таму што ў ім працякае мноства працэсаў. Сярод гэтых працэсаў перадача сігналу ад клетачнай мембраны да месцаў унутры клеткі, такіх як клетачнае ядро[50] і розныя арганелы[51]. У цытазолі таксама адбываюцца многія рэакцыі цытакінезу пасля распаду ядзернай абалонкі ў мітозе[52]. Іншая значная роля цытазоля — транспарт метабалітаў ад месцаў утварэння да месцаў выкарыстання. Сярод метабалітаў адносна простыя водарастваральныя малекулы, такія як амінакіслоты, якія могуць хутка дыфундзіраваць праз цытазоль[14]. Аднак гідрафобныя малекулы, такія як тлустыя кіслоты ці стэролы, могуць пераносіцца ў цытазолі з дапамогай адмысловых бялкоў, якія транспартуюць гэтыя малекулы паміж мембранамі[53][54]. У складзе везікул у цытазолі транспартуюцца малекулы, захопленыя пры эндацытозе ці прызначаныя для сакрэцыі[55]. Везікулы — гэта маленькія ліпідныя мяшэчкі, якія рухаюцца па цыташкілеце пры дапамозе маторных бялкоў[56].
У пракарыётаў у цытазолі працякае большасць метабалічных працэсаў[57], як і ў эўкарыётаў. Так, у сысуноў каля паловы бялкоў лакалізуюцца ў цытазолі[58]. Паказана, што ў дрожджаў амаль усе метабалічныя шляхі і метабаліты лакалізаваны ў цытазолі[59]. Сярод метабалічных працэсаў, якія ў жывёл працякаюць у цытазолі, — сінтэз бялку, пентозафасфатны шлях, гліколіз і глюканеагенез[60]. У іншых арганізмаў гэтыя метабалічныя шляхі могуць быць лакалізаваны інакш. Напрыклад, у раслін сінтэз тлустых кіслот працякае ў хларапластах[61][62], а ў апікомплексаў — у апікапласце[63].
Крыніцы[правіць | правіць зыходнік]
- ↑ а б в Ellis RJ (October 2001). "Macromolecular crowding: obvious but underappreciated". Trends Biochem. Sci. 26 (10): 597–604. doi:10.1016/S0968-0004(01)01938-7. PMID 11590012.
- ↑ Lardy, H. A. 1965. On the direction of pyridine nucleotide oxidation-reduction reactions in gluconeogenesis and lipogenesis. In: Control of energy metabolism, edited by B. Chance, R. Estabrook, and J. R. Williamson. New York: Academic, 1965, p. 245, [1].
- ↑ а б в г д Clegg James S. (1984). "Properties and metabolism of the aqueous cytoplasm and its boundaries". Am. J. Physiol. 246 (2 Pt 2): R133–51. doi:10.1152/ajpregu.1984.246.2.R133. PMID 6364846. S2CID 30351411.
- ↑ а б Cammack, Richard, Teresa Atwood, Campbell, Peter Scott, Parish, Howard I., Smith, Tony, Vella, Frank, Stirling, John (2006). Oxford dictionary of biochemistry and molecular biology. Oxford [Oxfordshire]: Oxford University Press. ISBN 0-19-852917-1. OCLC 225587597.
{{cite book}}: Папярэджанні CS1: розныя назвы: authors list (спасылка) - ↑ а б Lodish, Harvey F. (1999). Molecular cell biology. New York: Scientific American Books. ISBN 0-7167-3136-3. OCLC 174431482.
- ↑ Bowsher CG, Tobin AK (April 2001). "Compartmentation of metabolism within mitochondria and plastids". J. Exp. Bot. 52 (356): 513–27. doi:10.1093/jexbot/52.356.513. PMID 11373301.
- ↑ Goodacre R, Vaidyanathan S, Dunn WB, Harrigan GG, Kell DB (May 2004). "Metabolomics by numbers: acquiring and understanding global metabolite data" (PDF). Trends Biotechnol. 22 (5): 245–52. doi:10.1016/j.tibtech.2004.03.007. PMID 15109811. Архівавана з арыгінала (PDF) 2008-12-17.
- ↑ Weckwerth W (2003). "Metabolomics in systems biology". Annu Rev Plant Biol. 54: 669–89. doi:10.1146/annurev.arplant.54.031902.135014. PMID 14503007. S2CID 1197884.
- ↑ Reed JL, Vo TD, Schilling CH, Palsson BO (2003). "An expanded genome-scale model of Escherichia coli K-12 (iJR904 GSM/GPR)". Genome Biol. 4 (9): R54. doi:10.1186/gb-2003-4-9-r54. PMC 193654. PMID 12952533.
- ↑ Förster J, Famili I, Fu P, Palsson BØ, Nielsen J (February 2003). "Genome-Scale Reconstruction of the Saccharomyces cerevisiae Metabolic Network". Genome Res. 13 (2): 244–53. doi:10.1101/gr.234503. PMC 420374. PMID 12566402.
- ↑ Luby-Phelps K (2000). "Cytoarchitecture and physical properties of cytoplasm: volume, viscosity, diffusion, intracellular surface area" (PDF). Int. Rev. Cytol. International Review of Cytology. 192: 189–221. doi:10.1016/S0074-7696(08)60527-6. ISBN 978-0-12-364596-8. PMID 10553280. Архівавана з арыгінала (PDF) 2011-07-19.
- ↑ Roos A, Boron WF (April 1981). "Intracellular pH". Physiol. Rev. 61 (2): 296–434. doi:10.1152/physrev.1981.61.2.296. PMID 7012859.
- ↑ Bright, G R; Fisher, GW; Rogowska, J; Taylor, DL (1987). "Fluorescence ratio imaging microscopy: temporal and spatial measurements of cytoplasmic pH". The Journal of Cell Biology. 104 (4): 1019–1033. doi:10.1083/jcb.104.4.1019. PMC 2114443. PMID 3558476.
- ↑ а б Verkman AS (January 2002). "Solute and macromolecule diffusion in cellular aqueous compartments". Trends Biochem. Sci. 27 (1): 27–33. doi:10.1016/S0968-0004(01)02003-5. PMID 11796221.
- ↑ а б Wiggins PM (1 December 1990). "Role of water in some biological processes". Microbiol. Rev. 54 (4): 432–49. doi:10.1128/MMBR.54.4.432-449.1990. PMC 372788. PMID 2087221.
- ↑ Garlid KD (2000). "The state of water in biological systems". Int. Rev. Cytol. International Review of Cytology. 192: 281–302. doi:10.1016/S0074-7696(08)60530-6. ISBN 978-0-12-364596-8. PMID 10553283.
- ↑ Chaplin M (November 2006). "Do we underestimate the importance of water in cell biology?". Nat. Rev. Mol. Cell Biol. 7 (11): 861–6. doi:10.1038/nrm2021. PMID 16955076. S2CID 42919563.
- ↑ Wiggins PM (June 1996). "High and low density water and resting, active and transformed cells". Cell Biol. Int. 20 (6): 429–35. doi:10.1006/cbir.1996.0054. PMID 8963257. S2CID 42866068.
- ↑ Persson E, Halle B (April 2008). "Cell water dynamics on multiple time scales". Proc. Natl. Acad. Sci. U.S.A. 105 (17): 6266–71. Bibcode:2008PNAS..105.6266P. doi:10.1073/pnas.0709585105. PMC 2359779. PMID 18436650.
- ↑ а б в Lang F (October 2007). "Mechanisms and significance of cell volume regulation". J Am Coll Nutr. 26 (5 Suppl): 613S–623S. doi:10.1080/07315724.2007.10719667. PMID 17921474. S2CID 1798009.
- ↑ Sussich F, Skopec C, Brady J, Cesàro A (August 2001). "Reversible dehydration of trehalose and anhydrobiosis: from solution state to an exotic crystal?". Carbohydr. Res. 334 (3): 165–76. doi:10.1016/S0008-6215(01)00189-6. PMID 11513823.
- ↑ Crowe JH, Carpenter JF, Crowe LM (1998). "The role of vitrification in anhydrobiosis". Annu. Rev. Physiol. 60: 73–103. doi:10.1146/annurev.physiol.60.1.73. PMID 9558455.
- ↑ Berridge MJ (1 March 1997). "Elementary and global aspects of calcium signalling". J. Physiol. 499 (Pt 2): 291–306. doi:10.1113/jphysiol.1997.sp021927. PMC 1159305. PMID 9080360.
- ↑ Kikkawa U, Kishimoto A, Nishizuka Y (1989). "The protein kinase C family: heterogeneity and its implications". Annu. Rev. Biochem. 58: 31–44. doi:10.1146/annurev.bi.58.070189.000335. PMID 2549852.
- ↑ Orlov SN, Hamet P (April 2006). "Intracellular monovalent ions as second messengers". J. Membr. Biol. 210 (3): 161–72. doi:10.1007/s00232-006-0857-9. PMID 16909338. S2CID 26068558.
- ↑ Hudder A, Nathanson L, Deutscher MP (December 2003). "Organization of Mammalian Cytoplasm". Mol. Cell. Biol. 23 (24): 9318–26. doi:10.1128/MCB.23.24.9318-9326.2003. PMC 309675. PMID 14645541.
- ↑ Heuser J (2002). "Whatever happened to the 'microtrabecular concept'?". Biol Cell. 94 (9): 561–96. doi:10.1016/S0248-4900(02)00013-8. PMID 12732437. S2CID 45792524.
- ↑ Thanbichler M, Wang S, Shapiro L (2005). "The bacterial nucleoid: a highly organized and dynamic structure". J Cell Biochem. 96 (3): 506–21. doi:10.1002/jcb.20519. PMID 15988757. S2CID 25355087.
- ↑ Peters R (2006). "Introduction to Nucleocytoplasmic Transport". Xenopus Protocols. Methods in Molecular Biology. Vol. 322. pp. 235–58. doi:10.1007/978-1-59745-000-3_17. ISBN 978-1-58829-362-6. PMID 16739728.
- ↑ Zhou HX, Rivas G, Minton AP (2008). "Macromolecular crowding and confinement: biochemical, biophysical, and potential physiological consequences". Annu Rev Biophys. 37: 375–97. doi:10.1146/annurev.biophys.37.032807.125817. PMC 2826134. PMID 18573087.
- ↑ Norris V, den Blaauwen T, Cabin-Flaman A (March 2007). "Functional Taxonomy of Bacterial Hyperstructures". Microbiol. Mol. Biol. Rev. 71 (1): 230–53. doi:10.1128/MMBR.00035-06. PMC 1847379. PMID 17347523.
- ↑ Wang SQ, Wei C, Zhao G (April 2004). "Imaging microdomain Ca2+ in muscle cells". Circ. Res. 94 (8): 1011–22. doi:10.1161/01.RES.0000125883.68447.A1. PMID 15117829.
- ↑ Jaffe LF (November 1993). "Classes and mechanisms of calcium waves". Cell Calcium. 14 (10): 736–45. doi:10.1016/0143-4160(93)90099-R. PMID 8131190.
- ↑ Aw, T.Y. (2000). "Intracellular compartmentation of organelles and gradients of low molecular weight species". Int Rev Cytol. International Review of Cytology. 192: 223–53. doi:10.1016/S0074-7696(08)60528-8. ISBN 978-0-12-364596-8. PMID 10553281.
- ↑ Weiss JN, Korge P (20 July 2001). "The cytoplasm: no longer a well-mixed bag". Circ. Res. 89 (2): 108–10. doi:10.1161/res.89.2.108. PMID 11463714.
- ↑ Srere PA (1987). "Complexes of sequential metabolic enzymes". Annu. Rev. Biochem. 56: 89–124. doi:10.1146/annurev.bi.56.070187.000513. PMID 2441660.
- ↑ Perham RN (2000). "Swinging arms and swinging domains in multifunctional enzymes: catalytic machines for multistep reactions". Annu. Rev. Biochem. 69: 961–1004. doi:10.1146/annurev.biochem.69.1.961. PMID 10966480.
- ↑ Huang X, Holden HM, Raushel FM (2001). "Channeling of substrates and intermediates in enzyme-catalyzed reactions". Annu. Rev. Biochem. 70: 149–80. doi:10.1146/annurev.biochem.70.1.149. PMID 11395405. S2CID 16722363.
- ↑ Mowbray J, Moses V (June 1976). "The tentative identification in Escherichia coli of a multienzyme complex with glycolytic activity". Eur. J. Biochem. 66 (1): 25–36. doi:10.1111/j.1432-1033.1976.tb10421.x. PMID 133800.
- ↑ Srivastava DK, Bernhard SA (November 1986). "Metabolite transfer via enzyme-enzyme complexes". Science. 234 (4780): 1081–6. Bibcode:1986Sci...234.1081S. doi:10.1126/science.3775377. PMID 3775377.
- ↑ Groll M, Clausen T (December 2003). "Molecular shredders: how proteasomes fulfill their role". Curr. Opin. Struct. Biol. 13 (6): 665–73. doi:10.1016/j.sbi.2003.10.005. PMID 14675543.
- ↑ Nandi D, Tahiliani P, Kumar A, Chandu D (March 2006). "The ubiquitin-proteasome system" (PDF). J. Biosci. 31 (1): 137–55. doi:10.1007/BF02705243. PMID 16595883. S2CID 21603835. Архівавана (PDF) з арыгінала 2006-07-02.
- ↑ Bobik, T. A. (2007). "Bacterial Microcompartments" (PDF). Microbe. 2. Am Soc Microbiol: 25–31. Архівавана з арыгінала (PDF) 2008-08-02.
- ↑ Yeates TO, Kerfeld CA, Heinhorst S, Cannon GC, Shively JM (August 2008). "Protein-based organelles in bacteria: carboxysomes and related microcompartments". Nat. Rev. Microbiol. 6 (9): 681–691. doi:10.1038/nrmicro1913. PMID 18679172. S2CID 22666203.
- ↑ Badger MR, Price GD (February 2003). "CO2 concentrating mechanisms in cyanobacteria: molecular components, their diversity and evolution". J. Exp. Bot. 54 (383): 609–22. doi:10.1093/jxb/erg076. PMID 12554704.
- ↑ Cate JH (November 2001). "Construction of low-resolution x-ray crystallographic electron density maps of the ribosome". Methods. 25 (3): 303–8. doi:10.1006/meth.2001.1242. PMID 11860284.
- ↑ Provance DW, McDowall A, Marko M, Luby-Phelps K (1 October 1993). "Cytoarchitecture of size-excluding compartments in living cells". J. Cell Sci. 106 (2): 565–77. doi:10.1242/jcs.106.2.565. PMID 7980739.
- ↑ Luby-Phelps K, Castle PE, Taylor DL, Lanni F (July 1987). "Hindered diffusion of inert tracer particles in the cytoplasm of mouse 3T3 cells". Proc. Natl. Acad. Sci. U.S.A. 84 (14): 4910–3. Bibcode:1987PNAS...84.4910L. doi:10.1073/pnas.84.14.4910. PMC 305216. PMID 3474634.
- ↑ Luby-Phelps K (June 1993). "Effect of cytoarchitecture on the transport and localization of protein synthetic machinery". J. Cell. Biochem. 52 (2): 140–7. doi:10.1002/jcb.240520205. PMID 8366131. S2CID 12063324.
- ↑ Kholodenko BN (June 2003). "Four-dimensional organization of protein kinase signaling cascades: the roles of diffusion, endocytosis and molecular motors". J. Exp. Biol. 206 (Pt 12): 2073–82. doi:10.1242/jeb.00298. PMID 12756289. S2CID 18002214.
- ↑ Pesaresi P, Schneider A, Kleine T, Leister D (December 2007). "Interorganellar communication". Curr. Opin. Plant Biol. 10 (6): 600–6. doi:10.1016/j.pbi.2007.07.007. PMID 17719262.
- ↑ Winey M, Mamay CL, O'Toole ET (June 1995). "Three-dimensional ultrastructural analysis of the Saccharomyces cerevisiae mitotic spindle". J. Cell Biol. 129 (6): 1601–15. doi:10.1083/jcb.129.6.1601. PMC 2291174. PMID 7790357.
- ↑ Weisiger RA (October 2002). "Cytosolic fatty acid binding proteins catalyze two distinct steps in intracellular transport of their ligands". Mol. Cell. Biochem. 239 (1–2): 35–43. doi:10.1023/A:1020550405578. PMID 12479566. S2CID 9608133.
- ↑ Maxfield FR, Mondal M (June 2006). "Sterol and lipid trafficking in mammalian cells". Biochem. Soc. Trans. 34 (Pt 3): 335–9. doi:10.1042/BST0340335. PMID 16709155.
- ↑ Pelham HR (August 1999). "The Croonian Lecture 1999. Intracellular membrane traffic: getting proteins sorted". Philos. Trans. R. Soc. Lond. B Biol. Sci. 354 (1388): 1471–8. doi:10.1098/rstb.1999.0491. PMC 1692657. PMID 10515003.
- ↑ Kamal A, Goldstein LS (February 2002). "Principles of cargo attachment to cytoplasmic motor proteins". Curr. Opin. Cell Biol. 14 (1): 63–8. doi:10.1016/S0955-0674(01)00295-2. PMID 11792546.
- ↑ Hoppert M, Mayer F (1999). "Principles of macromolecular organization and cell function in bacteria and archaea". Cell Biochem. Biophys. 31 (3): 247–84. doi:10.1007/BF02738242. PMID 10736750. S2CID 21004307.
- ↑ Foster LJ, de Hoog CL, Zhang Y (April 2006). "A mammalian organelle map by protein correlation profiling". Cell. 125 (1): 187–99. doi:10.1016/j.cell.2006.03.022. PMID 16615899. S2CID 32197.
- ↑ Herrgård, MJ; Swainston, N; Dobson, P; Dunn, WB; Arga, KY; Arvas, M; Blüthgen, N; Borger, S; Costenoble, R; et al. (October 2008). "A consensus yeast metabolic network reconstruction obtained from a community approach to systems biology". Nature Biotechnology. 26 (10): 1155–60. doi:10.1038/nbt1492. PMC 4018421. PMID 18846089.
- ↑ Stryer, Lubert, Berg, Jeremy Mark, Tymoczko, John L. (2002). Biochemistry. San Francisco: W.H. Freeman. ISBN 0-7167-4684-0. OCLC 179705944.
{{cite book}}: Папярэджанні CS1: розныя назвы: authors list (спасылка) - ↑ Ohlrogge J, Pollard M, Bao X (December 2000). "Fatty acid synthesis: from CO2 to functional genomics". Biochem. Soc. Trans. 28 (6): 567–73. doi:10.1042/BST0280567. PMID 11171129.
- ↑ Ohlrogge JB, Kuhn DN, Stumpf PK (March 1979). "Subcellular localization of acyl carrier protein in leaf protoplasts of Spinacia oleracea". Proc. Natl. Acad. Sci. U.S.A. 76 (3): 1194–8. Bibcode:1979PNAS...76.1194O. doi:10.1073/pnas.76.3.1194. PMC 383216. PMID 286305.
- ↑ Goodman CD, McFadden GI (January 2007). "Fatty acid biosynthesis as a drug target in apicomplexan parasites". Curr Drug Targets. 8 (1): 15–30. doi:10.2174/138945007779315579. PMID 17266528. S2CID 2565225.
Гэты артыкул уваходзіць у лік добрых артыкулаў беларускамоўнага раздзела Вікіпедыі. |
